 調査・報告(野菜情報 2018年6月号)
調査・報告(野菜情報 2018年6月号)
加工用トマトの収穫作業を効率化するジョイントレス遺伝子
国立研究開発法人 農業・食品産業技術総合研究機構 食品研究部門 食品生物機能開発研究領域
分子生物機能ユニット上級研究員 伊藤 康博
【要約】
加工用トマトでは収穫効率を向上させることを目的に、通常の果柄に形成される離層構造ができなくなってしまう、「ジョイントレス」とよばれる形質が広く利用されている。近年その原因となる遺伝子の変異が明らかになってきた。今後は、離層形成の制御による他作物への応用が期待される。
加工用トマトでは収穫効率を向上させることを目的に、通常の果柄に形成される離層構造ができなくなってしまう、「ジョイントレス」とよばれる形質が広く利用されている。近年その原因となる遺伝子の変異が明らかになってきた。今後は、離層形成の制御による他作物への応用が期待される。
1 はじめに
(1) 作物の育種について
従来の作物の育種は、望ましい形質を持つ親系統同士を交配し、より良い形質を示す後代系統を選抜することで進められてきた。親植物として用いられるのは、現存する優れた品種が中心だが、突然変異が起きて良形質を示すようになった系統、あるいは交配可能な野生種・近縁種でも望ましい形質を持つ場合に親として用いられる。交配可能な植物間では、ほぼ同じ遺伝子のセットを持っており、性質が違うのは、それぞれの遺伝子の配列がほんの少しだけ違っていることでその機能が変化したためであり、その違いがいわゆる変異と言える。
現存の品種に対し、その品種にはないある良形質を別の系統(変異体)から取り入れたいということは、すなわちその形質を制御している遺伝子を親系統間で交換することである。良形質を示す変異遺伝子を取り入れる、ということになる。しかし交配育種の限界は、「交配可能な系統の中に目的の変異遺伝子があるかどうか」、になる。りんごにトマトの持つ有用な遺伝子を取り入れることは交配育種では不可能である。しかし、多くの植物は基本的に同じような仕組みで成長しており、違う植物の間でも基本的な遺伝子のセットは同じように持っており、その働きは共通であることが多い。だからこそ、モデル植物であるシロイヌナズナやイネで研究された仕組みが、さまざまな別の作物の研究に役立っているのである。つまりトマトで見つかった有用な変異形質をりんごでも取り入れたければ、トマトでその形質を引き起こしている遺伝子に対応するりんごの遺伝子が、同じような機能変化を示すように変異すればいいことになる。
トマトの有用な形質が、ある遺伝子が働かなくなるような変異が原因であるのならば、りんごでも対応する遺伝子を働かなくすれば、その有用な形質がりんごでも得られる可能性がある。ただし、その作物種の中で目的の遺伝子の変異を持つ系統が都合よく見つかれば交配による育種が可能であるが、そのようなことはまれである。
突然変異を新たに作る方法として、放射線や化学物質を用いた技術は古くからあるが、これらの手法ではゲノム中のどこで変異が発生するかをコントロールすることはできない。膨大な変異系統を育成し、その中から目的の変異を持つ系統を選抜する方法も開発されているが、育成した変異集団に目的の変異を起こした系統が含まれるかどうかは偶然に頼ることになり、目的の変異を見出すことができない可能性も少なくない。
(2) 遺伝子の働きを人為的に操作する手法
一方で、遺伝子の働きを人為的に操作する手法を活用することで、従来法では付与することが困難だった形質を持つ作物を育成できる可能性がある。遺伝子組換え法や、近年話題になっているゲノム編集法である。遺伝子組換え法では、ある遺伝子の働きを抑えることができたり、交配できない別の生物から遺伝子を取り込ませることもできたりする。ゲノム編集法は、遺伝子の狙った位置に突然変異を入れる目的で利用されることが多い。つまり前述のように、ある作物で見つかった良形質を示す変異が、どのような遺伝子のどのような機能変化なのかがしっかり研究されていれば、他の作物で同じような形質を持たせるには、対応する遺伝子に対してピンポイントに遺伝子組換え法やゲノム編集法による遺伝子操作を行うことで実現できる可能性がある。
つまりトマトで見つかった変異遺伝子を詳細に研究することで、りんごにおいてもその変異形質を再現できる可能性があり、近年の遺伝子操作技術の発展がそのような育種法のポテンシャルを拡大させている。遺伝子組換え作物に関しては、その栽培に認可が必要であり、また組換え体の栽培を懸念する強い声により、国内では商業的には栽培されていないが、諸外国で栽培された組換えダイズやナタネなどを大量に輸入し消費されているのが現状である。ゲノム編集法に関しては比較的新しい技術であり、国内ではゲノム編集された植物の栽培の規制に関して検討されているところである。
(3) 多肉質の果実を着ける作物研究のモデルとして扱われているトマト
トマトは多肉質の果実を着ける作物の研究においてモデルとして扱われており、トマトの収穫に関わる有用形質に関する研究は、果実を収穫する他のさまざまな作物種にとって、上述のような先端的な育種法開発に寄与する有益な情報源となりうる。
本稿では、筆者の研究グループがトマトの研究を進めている中で、偶然に見出した加工用トマトの収穫に関わる遺伝子の発見を述べ、りんごなどの他の作物の育種へ発展できる可能性もあるので、その内容を紹介する。
2 ジョイントレスとは?
スーパーで普通に見かけるトマトと、トマトソースやジュース、ケチャップといったトマト加工品を作るためのトマトとは、かなり違った性質を示すことは一般にはあまり知られていない。スーパーで並ぶトマトは多くが生で食べることを目的としたもので、ピンク系と呼ばれる皮が薄くて少し色が薄いタイプの品種が多い。
ス-パーでは、必ずヘタがついた状態で陳列されるが、ヘタの緑色は果実の赤色と鮮やかなコントラストを示し、いかにもおいしそうに見える。一方で、加工用のトマトは、皮は厚いが生食用トマトよりもずっと赤色が濃い品種が用いられる。これらはトマト果実の特徴的な赤色色素・リコペンをたくさん蓄積する性質を示す変異遺伝子を持つよう育種されてきた品種である。スーパーで買ってきたトマトを使ってジュースを作っても、市販のトマトジュースのように真っ赤にならないのは、市販のジュースに色素が添加されているわけではない。加工用にはもともとリコペンを多量に含む品種が使われているのである。
加工用トマトの特徴は、リコペン量の違いだけではない。もう一つ特徴的な形質がある。それが「ジョイントレス」である。生食用と加工用のトマト、これらの収穫時の違いはなんだろうか。上述の通りスーパーに並ぶトマトはヘタ付きであることが必須であるが、加工用トマトの収穫時にはヘタは不必要なので取り外される。トマトの植物体をよく観察すると、ヘタ(ガク)の上の枝の部分(果柄)中央に、少しふくらんだ「離層」という組織がある(図1)。果実を植物体から外そうと引っ張ると、ここからポキッと折れる。生食用トマトの収穫ならこれで良いが、加工用の場合はヘタの部分を取り外す必要がある(図2左)。
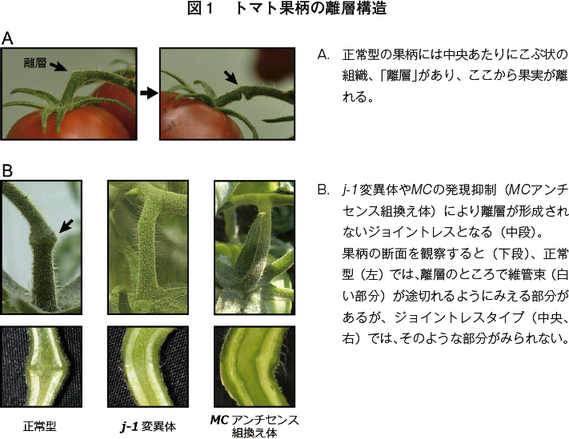
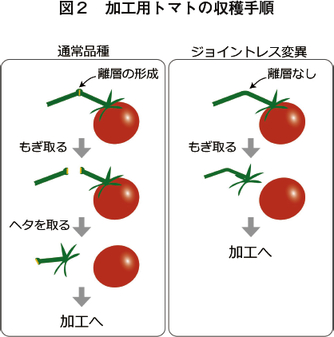
ところがトマトには果柄の離層ができなくなる突然変異があり、これを「ジョイントレス」と呼んでいる。ジョイントレス変異のトマトは、ヘタが植物本体から外れないので、収穫作業が1ステップ省略できる。
このジョイントレスタイプの植物では、果実を引っ張ると離層がないために果柄から外れることはない。外れるのは、次に植物と果実の間で物理的に結合が弱いところ、すなわちヘタの下となり、果実だけが収穫できる(図2右)。つまりジョイントレスにすると収穫時のヘタを取るステップが省略できるため、作業の効率化に大いに役立つ。大量に果実を収穫するためには、作業効率が少しでも向上することが望ましい。
ジョイントレストマトは収穫作業の効率化に大きく寄与するため、実際の加工用品種育成に世界中で広く取り入れられている。次の章でジョイントレス変異体の発見の経緯を述べるが、発見されたジョイントレス変異を加工用トマトの収穫効率を向上させるために使おうと思いついたのは、素晴らしいアイデアであるといつも感心させられる。
3 ジョイントレス変異体の由来
ジョイントレスを示す変異は、2種類ある。一つ目は文字通り jointless で、略称として j あるいは、後述する別の変異体と区別するために j-1と呼ばれている。ある系統のトマトは、いつも果実がヘタの下から外れるので、よく観察すると果柄に離層が形成されていない変異体であることが分かり、jointless と名付けられ1936年に報告された(注1)。もう一つは、ガラパゴス諸島から採取された近縁野生種 Solanum cheesmaniae が、ジョイントレス形質を示すことから発見された jointless-2 (j-2)である(注2)。後に、栽培種から全く同じ遺伝子座に変異が生じた系統が見つかっている(注3)(表1)。
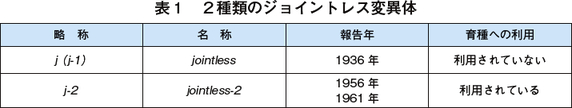
二つの変異のうち j-1 については、農業形質が良くないためあまり品種育成には利用されていない。トマトでは、一つの枝から分岐してたくさんの数の花を付ける「花房」を形成することが一般的であるが、 j-1の変異体では花房に、花芽が一つか二つかついたその先に成長点ができてしまい、先端から葉っぱがどんどん出て成長していってしまう。トマトの栽培では一般にわき目を摘み取って主茎を伸ばしていくが、花房の先端からも成長点が出ては都合が悪い。そもそも花房に一つか二つの果実では、収量が下がる。
一方で j-2 に関しては、ジョイントレスになる以外にこれといった形質の変化がみられないため、現在の育種に広く使われている。
注1:参考文献(1)
注2:参考文献(2)
注3:参考文献(3)
4 ジョイントレスに関わる遺伝子群の発見
ジョイントレス変異について、どのような遺伝子が変異を起こしたかを知ることで、離層が形成される仕組みが分かり他の作物の育種への応用も期待できる。j-1の遺伝子については、2000年に Maoらが報告した(注4)。当時はまだトマトの全ゲノム情報の解読がなされておらず、ジョイントレスと遺伝的に連鎖している DNAマーカーの利用により、 j-1が存在する染色体領域を特定して遺伝子を見出した。その結果、MADSボックスといわれる転写因子(注5)群の一つに突然変異が生じていることが明らかになった。この遺伝子同定の論文はNature誌に掲載されており、非常に高い注目を集めた発見だったと言える。
その後、同様の方法で j-2 遺伝子の単離を目指した研究が進められたが遺伝子を決定するには至らず、しばらく時が過ぎた。その間、別の二つのMADSボックス転写因子が離層形成に関与していることが明らかになった。まず筆者らによりMacrocalyx(MC)遺伝子が見つかり、その後別のグループにより SlMBP21が見出された。MCの発見については次章で詳述することにして、SlMBP21についてのLiuら(2014)(注6)の研究をまず述べる(表2)。

MADSボックス転写因子には種々の重要な農業形質に関与している例が知られ、機能未知のSlMBP21に関しても何らかの機能を見出そうという研究が行われた。いわゆる逆遺伝学的手法と呼ばれるが、アンチセンス遺伝子を遺伝子組換えにより導入して発現抑制を行った結果、組換え植物はジョイントレスを示したため、離層形成制御遺伝子の一つと結論付けられた。実はこの SlMBP21 の変異が j-2であることが後に明らかになるのだが、当初その可能性は否定されていた。SlMBP21と j-2とは同じ第12番染色体に位置することが分かっていたが、当時のゲノム情報(Sl2.40)からは j-2 が存在するとされた範囲内にSlMBP21が位置しないとされたため、これらは異なる遺伝子であると結論された。ところが最近になって j-2 の単離が成功し、SlMBP21における変異であることが2つの独立した研究から明らかになった(注7, 注8)。最初に SlMBP21が同定された当時のゲノム配列情報にはちょうどその領域で誤りがあったらしく、その後バーションアップされた配列情報(Sl2.50以降)では SlMBP21は j-2が存在すると予想されていた領域の間に位置するよう修正されている。SlMBP21を当初から研究していたグループは、世界中で実用的に広く利用されている遺伝子の同定という栄誉を逃したことになり、少々気の毒な話である。
注4:参考文献(4)
注5:転写とは、生体内で遺伝情報が伝えられる際の第一段階として、DNA(デオキシリボ核酸)の塩基配列を鋳型にして伝令RNA(リボ核酸)が合成されること。転写因子とは、遺伝子の転写を制御する因子であり、適切な細胞で、適切な時期に、必要な遺伝子を転写する、あるいは転写を抑制するために働く。
注6:参考文献(5)
注7:参考文献(6)
注8:参考文献(7)
5 MC遺伝子の離層形成に関する機能発見
(1) ripening inhibitor (rin)変異体を利用したトマトの成熟の研究
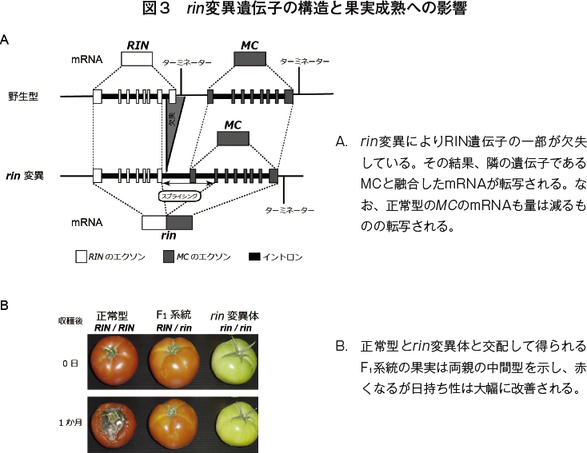
次に、筆者らがもう一つの離層形成に関わる遺伝子を発見した経緯について、まさに「セレンディピティ」(注9)の典型ともいえるその発見の過程を詳述してみたい。筆者らはもともとripening inhibitor (rin)という成熟の全く進まない変異を中心に、トマトの成熟の研究をしていた。既にrin遺伝子座は明らかになっており、正常型のRIN遺伝子とMC遺伝子が並んで位置していること、rin変異によるゲノム領域の欠失によりこの遺伝子座から転写されるmRNAはRINとMCの融合遺伝子になることが知られていた(図3A)。正常型ではRINが成熟の制御に関与しており、MCはガクの成長に関与しているとされた(注10)。また、正常型品種(RIN/RIN)とrin変異体(rin/rin)を交配して得られるF1系統(RIN/rin)は、両親の中間型を示し、カゴメ株式会社(以下「カゴメ」という)が開発したF1品種は十分な赤色を呈しながら極めて優れた日持ち性を示していた(図3B)(注11)。
注9:素敵な偶然に出会ったり、予想外のものを発見すること
注10:参考文献(8)
注11:参考文献(9)
(2) MCの離層形成制御機能の発見
遺伝学の基本であるメンデルの法則のうち、「優性の法則」の例として、えんどうの背丈の高い系統と低い系統を交配して得られる次の世代は、すべて背丈が高くなる、というように、対立遺伝子の両方を受け継いだ後代は両親の中間型ではなく、両親のどちらかの形質に近くなる、とされる。実際にはこのようにはっきりと優性の法則が適用されない形質も多い。
しかし RIN/rin の遺伝子型を持つF1トマトが優性の法則に従わず、中間型の形質を示すには何か理由があるのではないかと考えた。つまり正常型(RIN)遺伝子の存在量が半減するだけでなく、変異(rin)遺伝子が積極的に成熟抑制に働いているのではないか、と考えた。当時いろいろ頭をひねってこの仮説の証明を試みた中に、F1系統においてrin変異遺伝子の発現を抑制しようとする実験があった。
正常型と変異型の両方の遺伝子が発現しているF1系統のトマトに対して、変異型だけを発現抑制して働きを抑えた時に、その果実が正常型と同様の成熟進行をみせるようになれば、変異型遺伝子の成熟抑制効果が証明できると考えたのである。発現抑制にはアンチセンス法(注12)を用いたが、その時にアンチセンス遺伝子として用いたのがMCの一部だった。前述のとおり、rin変異遺伝子はRINとMCの融合遺伝子である。RINの部分をアンチセンスとして使うと正常型遺伝子の発現も抑制されるため、使用できない。
前述の通り、MC は成熟に影響する遺伝子ではなく、また離層形成への関与も論じられていなかった。そこでF1系統にMCのアンチセンス遺伝子を導入した組換えトマトを作出したところ、共同研究者であるカゴメの金原博士から予想外の指摘を受けた。
「ジョイントレスになっています。」
実はその時まで離層についてほとんど知識も関心もなかったので、あまりにも意外な現象だった。いろいろ検討した結果、アンチセンス遺伝子が当初の目的であるrin変異遺伝子だけでなく、もともとのMCの発現もしっかり抑制したために生じた現象であると考えられた。そこで通常の栽培種にMCアンチセンス遺伝子を改めて導入したところ、やはり果柄のジョイントレス化が再現された。このようにしてMCが離層形成に関与することを明らかにすることができた(注13)。前章で述べた二つに加え、MCの三つの離層形成に関わるMADSボックス転写因子は、複合体を形成することにより協調して離層形成を制御しているモデルが示されている。なお、rin変異遺伝子の成熟抑制機能についてであるが、その当時のMCアンチセンス遺伝子の実験では完全に証明することができなかったが、最近になってゲノム編集技術を利用することにより明らかにしている(注14)。
注12:標的遺伝子RNAに対して、相補鎖の一本鎖RNA(アンチセンスRNA)を用いて遺伝子発現を抑制する方法
注13:参考文献(10)
注14:参考文献(11)
6 他の作物への離層形成制御の応用の可能性
トマトでは、上述の通り離層形成に関わる三種のMADSボックス転写因子遺伝子が見出されているが、他の植物でも同様の機能を持つ遺伝子が存在する可能性は大いにある。筆者らはりんごから正常型の J-1に近い遺伝子を見出し、その遺伝子をトマトの j-1 変異体に導入したところ、ジョイントレスだった果柄に離層ができるようになった(図4)。
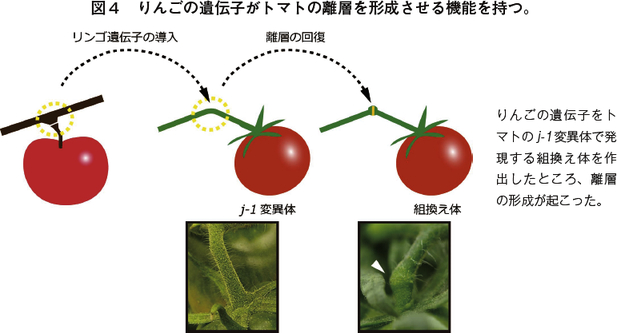
つまりりんごの遺伝子にトマトの果柄の離層形成を誘導する機能があったことになる(注15)。
ここから単純に、りんごでもこの遺伝子に変異が生ずれば必ずジョイントレスになるかと言えば、現時点ではやってみないとどうなるかわからないというのが実情である。しかし、りんごをジョイントレス化しようと試みるならば、遺伝子操作を行う有力な標的の候補であることは間違いない。りんごは台風による落果で大きな損害が出ることがあるが、落果は果柄の付け根の離層から生じることが多いので、「ジョイントレスりんご」が育成できれば台風被害を受けにくくなる可能性がある。近年、ゲノム編集法が植物でも広く応用されてきており、標的の遺伝子を狙って確実に変異を導入できるようになってきており、他作物でもジョイントレス変異を生み出すことができるかもしれない。トマトのジョイントレス変異が加工用トマトの重要形質になったように、他作物でも離層形成の制御によって農作業の効率化を可能とする技術が生まれることを期待したい。
注15:参考文献(12)
参考文献
(1)Butler, L. (1936) Inherited characters in the tomato. II. Jointless pedicel. J. Hered. 37, 25-26.
(2)Rick, C.M. (1956) Genetic and Systematic Studies on Accessions of Lycospersicon from the Galapagos Islands. Am J Bot 43, 687-696.
(3)Reynard, G.B. (1961) New Source of the j2 Gene Governing Jointless Pedicel in Tomato. Science 134, 2102.
(4)Mao, L. et al. (2000) JOINTLESS is a MADS-box gene controlling tomato flower abscission zone development. Nature 406, 910-3.
(5)Liu, D. et al. (2014) The SEPALLATA MADS-box protein SLMBP21 forms protein complexes with JOINTLESS and MACROCALYX as a transcription activator for development of the tomato flower abscission zone. Plant J 77, 284-96.
(6)Roldan, M.V.G. et al. (2017) Natural and induced loss of function mutations in SlMBP21 MADS-box gene led to jointless-2 phenotype in tomato. Sci Rep 7, 4402.
(7)Soyk, S. et al. (2017) Bypassing Negative Epistasis on Yield in Tomato Imposed by a Domestication Gene. Cell 169, 1142-1155 e12.
(8)Vrebalov, J. et al. (2002) A MADS-box gene necessary for fruit ripening at the tomato ripening-inhibitor (rin) locus. Science 296, 343-6.
(9)Kitagawa, M. et al. (2005) Characterization of tomato fruit ripening and analysis of gene expression in F1 hybrids of the ripening inhibitor (rin) mutant. Physiol Plant 123, 331-8.
(10)Nakano, T. et al. (2012) MACROCALYX and JOINTLESS interact in the transcriptional regulation of tomato fruit abscission zone development. Plant Physiol 158, 439-50.
(11)Ito, Y. et al. (2017) Re-evaluation of the rin mutation and the role of RIN in the induction of tomato ripening. Nat Plants 3, 866-874.
(12)Nakano, T. et al. (2015) Apple SVP Family MADS-Box Proteins and the Tomato Pedicel Abscission Zone Regulator JOINTLESS have Similar Molecular Activities. Plant Cell Physiol 56, 1097-106.